Reacción química entre bicarbonato sódico y vinagre YouTube

Los ácidos y las bases presentan características físicas diferentes: Ácidos. Presentan un sabor agrio (por ejemplo: ácido presente en diversos frutos cítricos). Son altamente corrosivos, pueden generar quemaduras químicas en la piel o daños respiratorios si se inhalan sus gases. Son buenos conductores de la electricidad en disoluciones.
Bicarbonato de sodio agua y vinagre un remedio Milagroso

Ácidos y bases. Las soluciones se clasifican como ácidas o básicas de acuerdo con su concentración de iones hidrógeno relativa al agua pura. Las soluciones ácidas tienen una concentración de H + mayor que el agua (mayor a 1 × 10 − 7 M), mientras que las soluciones básicas (alcalinas) tienen una concentración de H + menor (menor a 1.
Propiedades del bicarbonato sodico Diario Melilla

¿El bicarbonato de sodio es un ácido o una base? El bicarbonato de sodio, también conocido como bicarbonato de sodio o bicarbonato de sodio, es un compuesto químico ingenioso (NaHCO₃) que puede hacer muchas cosas geniales.
Equilibrio ácido base Buffer Bicarbonato Video 5 YouTube
El bicarbonato, también conocido como bicarbonato de sodio o hidrogenocarbonato, es una sustancia química presente en el cuerpo humano que actúa como un tampón para regular el equilibrio ácido-base del organismo.. La fórmula química del bicarbonato es HCO3-. Se trata de un anión formado por la combinación de un átomo de carbono, tres átomos de oxígeno y un átomo de hidrógeno.
bicarbonatodesodioenaguareaccion Ciencia y cosmética

Ácidos y bases de Arrhenius. El pH, pOH y la escala de pH. Ácidos y bases de Brønsted-Lowry. Ácidos y bases de Brønsted-Lowry. Autoionización del agua. La autoionización del agua y la Kw. Definición de pH. Fuerza de los ácidos, tamaño de los aniones y energía de enlace.
Bicarbonato De Sodio Formula

Identificar bases y ácidos de Brønsted-Lowry. En la reacción entre el agua y el ácido nítrico, el ácido nítrico, HNO 3 , dona un protón (en azul) al agua, de tal forma que actúa como un ácido de Brønsted-Lowry. H NO 3 ( a c) + H 2 O ( l) → H 3 O + ( a c) + NO 3 − ( a c) Puesto que el agua acepta el protón del ácido nítrico.
PPT Bicarbonatos PowerPoint Presentation, free download ID6404206

Bicarbonato (HCO − 3) es un componente vital del sistema de amortiguación del pH del cuerpo humano (mantiene el ácido- homeostasis básica).Entre el 70 % y el 75 % del CO 2 del cuerpo se convierte en ácido carbónico (H 2 CO 3), que es el ácido conjugado de HCO − 3 y puede convertirse rápidamente en él.. Con el ácido carbónico como la especie intermedia central, el bicarbonato.
Reabsorción de bicarbonato en el equilibrio ácidobase. YouTube

El bicarbonato, generalmente en forma de bicarbonato de sodio, Na2CO3, se considera una Base porque, dependiendo del pH de la solución, el ion carbonato absorberá preferentemente hasta dos protones del entorno circundante y los unirá electrostáticamente en HCO3- o H2CO3. En términos del concepto BL ácido / base, el bicarbonato es una.
6 Beneficios Del Agua Con Bicarbonato De Sodio En Nuestro Organismo Delicias Blog

Bicarbonate ( HCO−. 3) is a vital component of the pH buffering system [3] of the human body (maintaining acid-base homeostasis ). 70%-75% of CO 2 in the body is converted into carbonic acid (H 2 CO 3 ), which is the conjugate acid of HCO−. 3 and can quickly turn into it. [citation needed]
Equilibrio ácido base.

El bicarbonato sódico intravenoso en solución acuosa se utiliza a veces en casos de acidosis, o cuando no hay suficientes iones de sodio o bicarbonato en la sangre. En casos de acidosis respiratoria, el ión bicarbonato infundido impulsa el tampón ácido carbónico/bicarbonato del plasma hacia la izquierda, y eleva así el pH.
Sodio, bicarbonato, cloro y equilibrio acidobase

Ana Martinez ( amartinez02@saintmarys.edu ) contribuyó a la traducción de este texto. 14.1: Los ácidos y bases de Brønsted-Lowry. Los compuestos que donan un protón (ion de hidrógeno) se llaman ácidos Brønsted-Lowry. El compuesto que acepta el protón se llama la base Brønsted-Lowry. La..
Baking Soda Molecular Formula Sodium Bicarbonate
/sodiumbicarbonate2-599f0a4cb501e800113dd78f.png)
Es una sal compuesta por un catión sodio (Na+) y un anión bicarbonato (HCO3−). El bicarbonato de sodio es un sólido blanco que es cristalino, pero a menudo aparece como un polvo fino. Tiene un sabor ligeramente salado y alcalino que se asemeja al de la soda para lavar (carbonato de sodio). La forma mineral natural es nahcolita.
Sodium Bicarbonate Chemical Structure Photograph by Molekuul/science Photo Library Fine Art
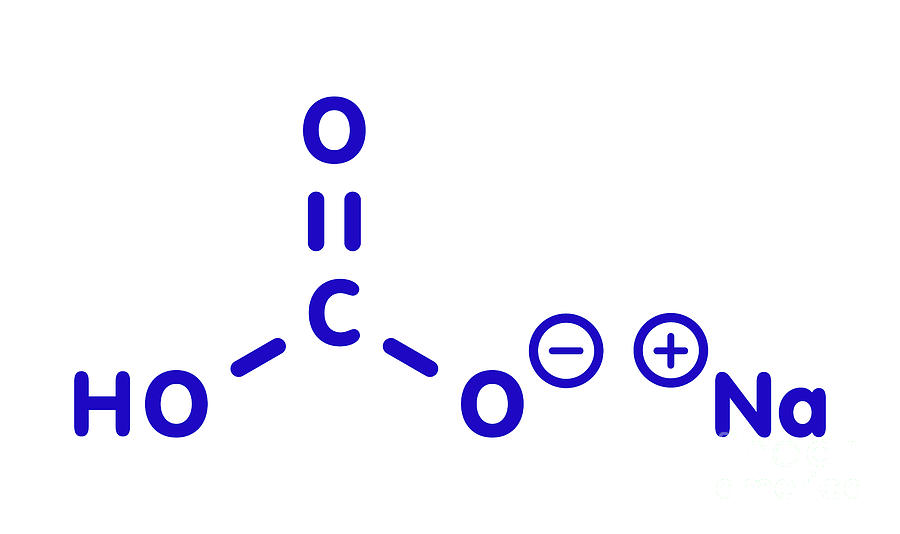
El bicarbonato de sodio es un compuesto inorgánico cuya fórmula química es NaHCO3, se encuentra de manera natural en minerales llamados natrón.Se trata de un sólido cristalino, con el aspecto de un polvo fino y blanco, es inodoro, soluble en agua y alcalino.. Cuando el bicarbonato se disuelve en un líquido, ya sea agua, sangre, u orina, da lugar a sodio y bicarbonato, volviendo la.
Sustancias ácidobase Acidos bases, Bicarbonato de sodio, Acida

Tanto en química como en panadería, el bicarbonato de sodio se considera una base porque genera una reacción cuando se mezcla con ácidos, como suero de leche, yogur o vinagre. Esta reacción química produce dióxido de carbono (CO 2) en forma de burbujas, como una espuma líquida. El proceso que crea el bicarbonato de sodio se llama.
PPT EQUILIBRIO ACIDOBASE PowerPoint Presentation, free download ID6259785

Bicarbonato. Los bicarbonatos son sales ácidas derivadas del ácido carbónico (H 2 CO 3) que contienen el anión bicarbonato (HCO 3- ). El nombre bicarbonato está aún muy extendido en el comercio y la industria, pero no está recomendado por la IUPAC: se prefiere el nombre antiguo admitido anión supercarbonato o si es una sal ácida.
Reacción química del bicarbonato de soda (bicarbonato sódico) y el vinagre (ácido acético

Un valor de pH más bajo significa un ácido más fuerte, y un valor de pH más alto significa una base más fuerte. Esto puede ser un poco confuso, pero entre más bajo es el pH de una sustancia, más fuerte es el ácido. A veces ayuda pensar que entre más lejos del valor neutro está una sustancia, más fuerte es en dirección ácida o básica.